Câu hỏi:
04/07/2024 300Đọc thông tin dưới đây và trả lời các câu hỏi từ câu 41 - 47:
Thuật ngữ axit hoặc bazơ (axit hoặc kiềm) vẫn thường xuất hiện rất phổ biến trong đời sống gia đình. Để nhận biết một dung dịch có môi trường là axit hay là bazơ người ta sử dụng tới chất chỉ thị axit – bazơ. Chất chỉ thị axit – bazơ là chất có màu sắc biến đổi phụ thuộc vào giá trị pH của dung dịch. Một trong những chất chỉ thị thông dụng nhất trong các kĩ thuật chuẩn độ đó là phenolphtalein.
Adolf van Bayer đã phát hiện ra phenolphtalein vào năm 1871. Ông đã quan sát thấy sự hình thành của phenolphtalein khi đun nóng phenol với anhyđrit phthalic với sự có mặt của axit:
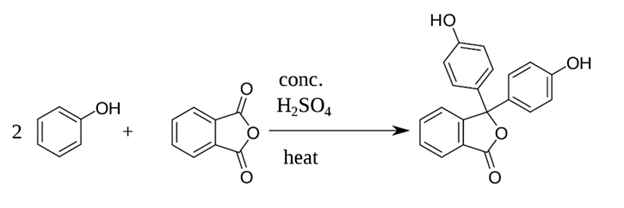
Phenolphtalein là chất rắn kết tinh không màu, đôi khi nó có thể ở dạng bột màu vàng nhạt hoặc màu cam. Đây là một chất không tan trong nước nhưng tan trong cồn Ở trạng thái tự nhiên, phenolphtalein tồn tại ở dạng axit yếu không màu, được kí hiệu là HIn. Hằng số phân li axit (Ka) của HIn là 3×10−10. Bazơ liên hợp của nó có màu đỏ hồng đậm. Trong dung dịch nước, phenolphtalein sẽ có trạng thái cân bằng như sau:
HIn + H2O ⇌ In− + H3O+
Theo nguyên lý chuyển dịch cân bằng Le Chatelier, trạng thái cân bằng trên sẽ chuyển dịch sang trái nếu nồng độ của H3O+ tăng lên, tức là trong dung dịch ưu tiên chiều phản ứng: In− + H3O+ → HIn + H2O hơn. Nếu dung dịch có tính bazơ mạnh thì cân bằng chuyển dịch sang phải vì ion OH− sẽ phản ứng với các phân tử HIn chuyển chúng thành In−.
Trong các phép chuẩn độ, phenolphtalein được thêm vào để nhận ra điểm dừng chuẩn độ. Tại điểm này có sự thay đổi màu sắc đột ngột của dung dịch được chuẩn độ vì có sự thay đổi của pH trong môi trường chuẩn độ làm thay đổi trạng thái tồn tại của chất chỉ thị mà, từ đó màu của chỉ thị sẽ thay đổi là một dấu hiệu nhận biết đã đến lúc cần dừng chuẩn độ. Người ta coi rằng có một pH trung gian nào đó một nửa phenolphtalein ở dạng axit và một nửa ở dạng bazơ liên hợp có màu. Độ pH trung gian này có thể được tính theo phương trình Henderson – Hasselbalch cho trạng thái cân bằng chỉ thị:Công thức phân tử của hợp chất phenolphtalein là
Sách mới 2k7: 30 đề đánh giá năng lực DHQG Hà Nội, Tp. Hồ Chí Minh, BKHN 2025 mới nhất (600 trang - chỉ từ 160k).
Quảng cáo
Trả lời:
Phương pháp giải
Dựa vào phương trình tổng hợp phenolphtalein, sản phẩm cuối cùng là công thức cấu tạo của phenolphtalein. Từ công thức cấu tạo suy ra được công thức phân tử.
Lời giải
Công thức phân tử của phenolphtalein là C20H14O4.
Chọn A
Câu hỏi cùng đoạn
Câu 2:
Lời giải của GV VietJack
Phương pháp giải
Dựa vào hình ảnh về công thức cấu tạo phenolphtalein.
Lời giải
Những đáp án mô tả thành phần và cấu trúc đúng của phân tử phenolphtalein là:
- Vòng thơm 6 cạnh.
- Phenol.
- Xeton.
- Dị vòng có chứa O.
Chọn A, C, F, I
Câu 3:
Chọn các đáp án đúng:
Những yếu tố chỉ ra rằng phenolphtalein là axit yếu là
|
|
ĐÚNG |
SAI |
|
Trong cấu trúc của phenolphtalein có 2 vòng phenol có tính axit yếu nên gây cho phenolphtalein có tính axit yếu. |
||
|
Trong cấu trúc của phenolphtalein có nhóm chức của axit cacboxylic nên gây ra tính axit yếu của phenolphtalein. |
||
|
Ka của axit HIn rất nhỏ, do đó khả năng phân li ra ion H+ của axit này rất yếu, nên tính axit của HIn yếu. |
Lời giải của GV VietJack
Đáp án
|
|
ĐÚNG |
SAI |
|
Trong cấu trúc của phenolphtalein có 2 vòng phenol có tính axit yếu nên gây cho phenolphtalein có tính axit yếu. |
X | |
|
Trong cấu trúc của phenolphtalein có nhóm chức của axit cacboxylic nên gây ra tính axit yếu của phenolphtalein. |
X | |
|
Ka của axit HIn rất nhỏ, do đó khả năng phân li ra ion H+ của axit này rất yếu, nên tính axit của HIn yếu. |
X |
Phương pháp giải
Dựa vào các thông tin về phenolphtalein.
Lời giải
- Nhận định “Trong cấu trúc của phenolphtalein có 2 vòng phenol có tính axit yếu nên gây cho phenolphtalein có tính axit yếu” là đúng.
- Nhận định “Trong cấu trúc của phenolphtalein có nhóm chức của axit cacboxylic nên gây ra tính axit yếu của phenolphtalein” là sai, vì trong cấu trúc của phenolphtalein không có nhóm chức axit cacboxylic.
- Nhận định “Ka của axit HIn rất nhỏ, do đó khả năng phân li ra ion H+ của axit này rất yếu, nên tính axit của HIn yếu”.
Câu 4:
Điền số thích hợp vào chỗ trống (Làm tròn đến chữ số thập phân thứ nhất)
pH trung gian mà tại đó người ta mong chờ có sự đổi màu của chỉ thị phenolphtalein là _______.
Lời giải của GV VietJack
Đáp án: "9,5"
Phương pháp giải
Dựa vào công thức của phương trình Henderson – Hasselbalch: \(pH = p{K_a} + \log \frac{{\left[ {I{n^ - }} \right]}}{{[HIn]}}\).
Lời giải
Ka của HIn là 3×10−10, thay vào phương trình Henderson – Hasselbalch ta có:
\(pH = - \log \left( {3 \times {{10}^{ - 10}}} \right) + \log 1 = 9,5\)
Vậy số cần điền là 9,5.
Câu 5:
Kéo thả cụm từ thích hợp vào chỗ trống
không màu, màu hồng, HIn, In-, từ không màu sang màu hồng nhạt, từ màu hồng nhạt sang không màu
- Khi cho phenolphtalein vào cốc đựng dung dịch nước chanh có pH = 2,4 thì chỉ thị có màu _______.Khi cho phenolphtalein vào cốc đựng dung dịch Ba(OH)2 nồng độ 0,1M thì nồng độ của _______ trong dung dịch lớn hơn nồng độ của _______.- Trong phép chuẩn độ dung dịch HCl bằng dung dịch NaOH, sự đổi màu của dung dịch HCl trộn thêm chất chỉ thị phenolphtalein là _______.
Lời giải của GV VietJack
Đáp án
- Khi cho phenolphtalein vào cốc đựng dung dịch nước chanh có pH = 2,4 thì chỉ thị có màu không màu .Khi cho phenolphtalein vào cốc đựng dung dịch Ba(OH)2 nồng độ 0,1M thì nồng độ của In− trong dung dịch lớn hơn nồng độ của HIn .
- Trong phép chuẩn độ dung dịch HCl bằng dung dịch NaOH, sự đổi màu của dung dịch HCl trộn thêm chất chỉ thị phenolphtalein là từ không màu sang màu hồng nhạt.
Phương pháp giải
Dựa vào quá trình chuẩn độ bằng chất chỉ thị phenolphtalein.
Lời giải
- Khi cho phenolphtalein vào cốc đựng dung dịch nước chanh có pH = 2,4 thì chỉ thị có màu không màu vì môi trường 0 < pH < 8 thì phenolphtalein khộng đổi màu.
- Khi cho phenolphtalein vào cốc đựng dung dịch Ba(OH)2 nồng độ 0,1M thì nồng độ của In− trong dung dịch lớn hơn nồng độ của HIn.
- Trong phép chuẩn độ dung dịch HCl bằng dung dịch NaOH, sự đổi màu của dung dịch HCl trộn thêm chất chỉ thị phenolphtalein là từ không màu sang màu hồng nhạt.
Câu 6:
Để tổng hợp 18 mol phenolphtalein theo quá trình đã được Adolf van Bayer đã phát hiện ra vào năm 1871 cần bao nhiêu gam chất phản ứng? Biết phản ứng có hiệu suất 90%.
Lời giải của GV VietJack
Phương pháp giải
Tính số mol phenolphtalein theo lý thuyết thu được, từ đó tính được số mol các chất phản ứng tham gia
⇒ tính tổng khối lượng các chất phản ứng bao gồm khối lượng của phenol với anhyđrit phthaliC.
Lời giải
Phương trình tổng hợp phenolphtalein theo Adolf van Bayer là:
\({{\rm{C}}_6}{{\rm{H}}_5}{\rm{OH}} + {{\rm{C}}_6}{{\rm{H}}_4}{({\rm{CO}})_2}{\rm{O}} \to {{\rm{C}}_{20}}{{\rm{H}}_{14}}{{\rm{O}}_4}\)
Vì hiệu suất của phản ứng là 90% ⇒ Số mol HIn lý thuyết thu được là nHIn = 18 : 90% = 20mol
\( \Rightarrow {n_{{C_6}{{\rm{H}}_5}{\rm{OH}}}} = {n_{{{\rm{C}}_6}{{\rm{H}}_4}{{({\rm{CO}})}_2}{\rm{O}}}} = 20\;{\rm{mol}}\)
⇒ Khối lượng chất phản ứng là:
\(m = {m_{{C_6}{{\rm{H}}_5}{\rm{OH}}}} + {m_{{{\rm{C}}_6}{{\rm{H}}_4}{{({\rm{CO}})}_2}{\rm{O}}}} = 20.94 + 20.148 = 4840\,\,{\rm{gam}}\)
Chọn A
Câu 7:
Nhận định dưới đây là đúng hay sai
Nồng độ ion H+ ảnh hưởng tới trạng thái tồn tại của HIn.
Lời giải của GV VietJack
Phương pháp giải
Dựa vào cân bằng của phenolphtalein
Lời giải
Nồng độ ion H+ ảnh hưởng trực tiếp tới quá trình chuyển đổi của HIn trong dung dịch. Khi nồng độ của ion H+ tăng lên, H+ sẽ tác dụng với H2O ra \({{\rm{H}}^ + } + {{\rm{H}}_2}{\rm{O}} \to {{\rm{H}}_3}{{\rm{O}}^ + }\), từ đó làm cho nồng độ H3O+ tăng lên, cân bằng chuyển dịch sang bên trái, dạng axit là HIn sẽ tồn tại chủ yếu và ngược lại.
Chọn B
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Phần tư duy đọc hiểu
Từ đoạn số [1], cụ Kép nghĩ rằng mình không phù hợp để chơi hoa vì lí do nào sau đây?
Câu 3:
Chất nào là chất mà theo hai nhà khoa học phải có mặt để tạo ra CH3 từ metan trong bầu khí quyển?
Câu 4:
Một hệ gồm 4 nam châm được sắp xếp như hình sau. Các nhận xét sau đây về tương tác giữa các nam châm là đúng?
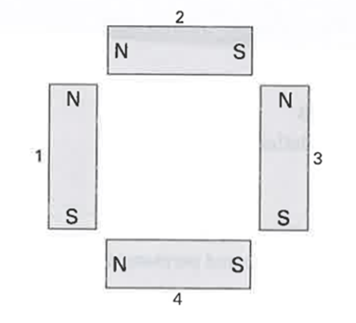
Câu 5:
Chọn các đáp án chính xác
Tế bào ung thư có đặc điểm nào sau đây?
Câu 6:
tuần hoàn, thần kinh, hô hấp
Khi cơ thể bị nhiễm virus cúm có thể dẫn đến suy _______ và tử vong.
về câu hỏi!