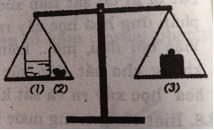
Bài 15: Định luật bảo toàn khối lượng
30 người thi tuần này 5.0 43.9 K lượt thi 10 câu hỏi
- Đề số 1
- Đề số 2
- Đề số 3
- Đề số 4
- Đề số 5
- Đề số 6
- Đề số 7
- Đề số 8
- Đề số 9
- Đề số 10
- Đề số 11
- Đề số 12
- Đề số 13
- Đề số 14
- Đề số 15
- Đề số 16
- Đề số 17
- Đề số 18
- Đề số 19
- Đề số 20
- Đề số 21
- Đề số 22
- Đề số 23
- Đề số 24
- Đề số 25
- Đề số 26
- Đề số 27
- Đề số 28
- Đề số 29
- Đề số 30
- Đề số 31
- Đề số 32
- Đề số 33
- Đề số 34
- Đề số 35
🔥 Đề thi HOT:
Đề kiểm tra 15 phút Hóa học 8 Chương 3: Mol và tính toán hóa học (Đề 2)
Trắc nghiệm Hóa 8 Bài 20 (có đáp án): Tỉ khối của chất khí
Đề kiểm tra 15 phút Hóa học 8 Chương 1: Chất - Nguyên tử - Phân tử (Đề 1)
Đề thi Học kì 1 Hóa học lớp 8 cực hay, có đáp án (Đề 1)
Danh sách câu hỏi:
Lời giải
Theo định luật bảo toàn khối lượng ta có:
Lời giải
= (6,5 + 7,3) – 13,6 = 0,2(g)
Lời giải
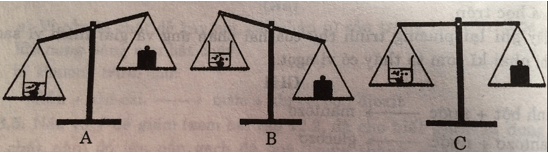
Chọn B. Vì khi cho đá vôi vào dung dịch axit clohiric có phản ứng sinh ra khí cacbon dioxit thoát ra ngoài làm cho khối lượng sẽ giảm đi.
Lời giải
Khi nung đá vôi thì có khí cacbon đioxit thoát ra nên khối lượng giảm đi.
Lời giải
Vì khi đun nóng miếng đồng trong không khí thì đồng hóa hớp với oxi tạo ra chất mới nên khối lượng tăng. (khối lượng sau gồm khối lượng miếng đồng ban đầu + khối lượng oxi phản ứng)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.