Bộ 9 Đề thi Hóa 11 giữa kì 1 có đáp án (Đề 9)
27 người thi tuần này 4.6 6.8 K lượt thi 31 câu hỏi 60 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi giữa kì 2 Hóa 11 Kết nối tri thức có đáp án - Đề 2
Bộ 3 đề thi giữa kì 2 Hóa 11 Kết nối tri thức có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 11 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 11 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi giữa kì 2 Hóa 11 Chân trời sáng tạo có đáp án - Đề 3
Bộ 3 đề thi giữa kì 2 Hóa 11 Chân trời sáng tạo có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 11 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 11 Cánh diều cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
Đáp án A
Khi tan trong nước các dung dịch: CuSO4, NaCl, KBr có khả năng phân li ra ion.
CH3OH trong dung dịch không có khả năng phân li ion nên không dẫn điện.
Lời giải
Đáp án C
Chất điện li yếu: CH3COOH.
Phương trình điện li: CH3COOHCH3COO-+ H+
Câu 3
A. Sự phân li các chất thành các phân tử nhỏ hơn.
B. Sự phân li các chất thành ion khi tan trong nước.
C. Sự phân li các chất thành các nguyên tử cấu tạo nên
D. Sự phân li các chất thành các chất đơn giản
Lời giải
Đáp án B
Sự điện li là sự phân li các chất thành ion khi tan trong nước.
Câu 4
A. NaCl → Na2++ Cl-
B. CH3COOH → CH3COO-+ H+
C. C2H5OH → C2H5++ OH-
D. Ca(OH)2→ Ca2++ 2OH-
Lời giải
Đáp án D
Phương trình điện li viết đúng là Ca(OH)2→ Ca2++ 2OH-
A sai vì NaCl → Na++ Cl-
B sai vì CH3COOH là chất điện li yếu.
C sai vì C2H5OH là chất không điện li.
Câu 5
A. NH4NO3
B. Al2(SO4)3
C. Ba(OH)2
D. H2SO4
Lời giải
Đáp án B
Dung dịch có nồng độ các ion càng lớn thì độ dẫn điện càng tốt.
Nồng độ mol các dung dịch là 1M.
Ý A. NH4NO3 → NH4+ + NO3–suy ra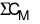 ion = 2M.
ion = 2M.
Ý B. Al2(SO4)3 → 2Al3+ + 3SO42– suy ra 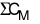 ion = 5M.
ion = 5M.
Ý C. Ba(OH)2 → Ba2+ + 2OH– suy ra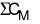 ion = 3M.
ion = 3M.
Ý D. H2SO4 → 2H+ + SO42– suy ra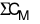 ion = 3M.
ion = 3M.
Vậy dung dịch Al2(SO4)3 dẫn điện tốt nhất
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. [H+] = 0,10M.
B. [H+] >[NO3-].
C. [H+]< [NO3-].
D. [H+]< 0,10M.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
A. 0,45M.
B. 0,90M.
C. 1,35M.
D. 1,00M.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
A. KOH + HNO3KNO3+ H2O
B. Cu(OH)2+ H2SO4CuSO4+ 2H2O
C. KHCO3+ KOH K2CO3+ H2O
D. Cu(OH)2+ 2HNO3Cu(NO3)2+ 2H2O
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
A. NH3và Fe(NO3)3.
B. CuSO4và KOH.
C. Na2CO3và Ca(OH)2.
D. NaOH và H2SO4.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
A. NaCl, NaOH, NH3, Ba(OH)2.
B. NaCl, NH3, NaOH, Ba(OH)2
C. NH3, NaCl, NaOH, Ba(OH)2
D. NaCl, Ba(OH)2, NaOH, NH3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
A. HCl.
B. NaOH.
C. BaCl2.
D. H2SO4.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
A. Nitơ có bán kính nguyên tử nhỏ.
B. Nguyên tử nitơ có độ âm điện lớn nhất trong nhóm nitơ.
C. Số oxi hóa của nguyên tử nitơ bằng 0 nên rất bền.
D. Trong nguyên tử N2có liên kết ba bền.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 18
A. LiN3và Al3N.
B. Li2N3và Al2N3.
C. Li3N và AlN.
D. Li3N2và Al3N2.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 19
A. Màu vàng.
B. Màu hồng.
C. Màu cam.
D. Màu xanh.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 22
A. NO.
B. NH4NO3.
C. NO2.
D. N2O5.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 23
A. Fe, Al, Cr
B. Cu, Fe, Al
C. Fe, Mg, Al
D. Cu, Pb, Ag.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 24
A. 2NH3 + H2SO4→ (NH4)2SO4
B. NH3 + HCl → NH4Cl
C.8NH3+ 3Cl2→ 6NH4Cl + N2
D. Al(NO3)3+ 3NH3+ 3H2O → Al(OH)3+ 3NH4NO3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 25
A. 4NH3+ 5O2→ 4NO + 6H2O.
B. 2NO + O2→ 2NO2
C. 4NO2+ O2+ 2H2O → 4HNO3
D. N2O5 + H2O → 2HNO3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 26
A. KNO3+ S.
B. KClO3+ C.
C. KClO3+ C + S.
D. KNO3+ C + S
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 28
A. 3.
B. 10.
C. 9.
D. 12.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.