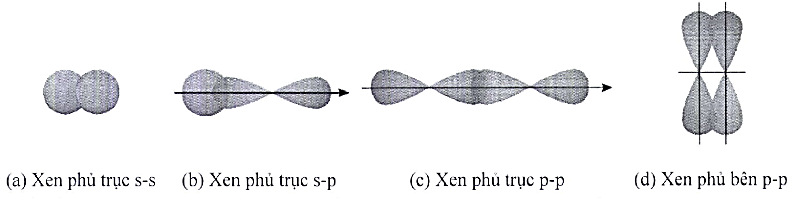
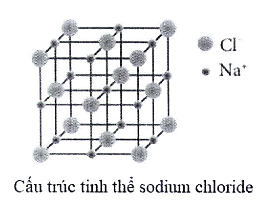
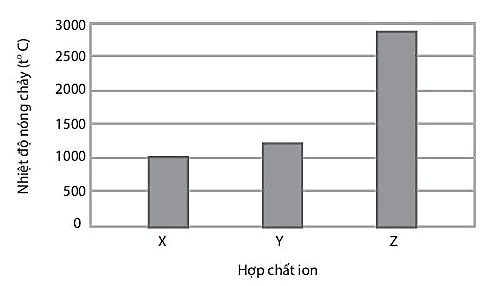
30 bài tập Liên kết hóa học có đáp án
50 người thi tuần này 4.6 1.7 K lượt thi 30 câu hỏi 60 phút
🔥 Đề thi HOT:
Đề thi thử THPTQG 2019 môn Hóa học cực hay có lời giải chi tiết (P1)
Đề Ôn thi THPTQG 2019 Hóa Học cơ bản, nâng cao có lời giải chi tiết (P1)
Tổng hợp đề thi Thử Hóa học cực hay có lời giải (Đề số 1)
Đề thi thử Hóa học cực hay có lời giải chi tiết (đề số 1)
Tổng hợp minh họa THPTQG 2019 Hóa Học có lời giải (Đề số 1)
Tổng hợp đề thi thử THPTQG 2019 - chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Bộ đề tăng tốc luyện thi Hóa Học cực hay có lời giải chi tiết (đề số 1)
15 Đề thi thử THPTQG 2019 Hóa Học chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Nội dung liên quan:
Danh sách câu hỏi:
Lời giải
Chọn D
Câu 2
Lời giải
Chọn B
Câu 3
B. Số liên kết trong phân tử ![]() bằng số liên kết trong phân tử
bằng số liên kết trong phân tử ![]()
C. Trong phân tử ![]() và phân tử
và phân tử ![]() chỉ có các liên kết cộng hóa trị.
chỉ có các liên kết cộng hóa trị.
D. Do có liên kết hydrogen giữa các phân tử nên ![]() có nhiệt độ sôi cao hơn H2S.
có nhiệt độ sôi cao hơn H2S.
Lời giải
Chọn A
Câu 4
Lời giải
Chọn D
Câu 5
Lời giải
Chọn B
Câu 6
A. Vì chúng có lớp electron ngoài cùng đã bão hoà.
B. Vì chúng có phân lớp electron bên trong đã được được điền đầy đủ.
C. Vì bán kính nguyên tử của chúng rất nhỏ.
D. Vì mỗi nguyên tử đã có đủ 8 electron.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 9
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.