Trắc nghiệm tổng hợp ôn thi tốt nghiệp THPT môn Hóa Bài 20. Sơ lược về kim loại chuyển tiếp dãy thứ nhất có đáp án
53 người thi tuần này 4.6 3.4 K lượt thi 55 câu hỏi 60 phút
🔥 Đề thi HOT:
Đề thi thử THPTQG 2019 môn Hóa học cực hay có lời giải chi tiết (P1)
Đề Ôn thi THPTQG 2019 Hóa Học cơ bản, nâng cao có lời giải chi tiết (P1)
Tổng hợp đề thi Thử Hóa học cực hay có lời giải (Đề số 1)
Đề thi thử Hóa học cực hay có lời giải chi tiết (đề số 1)
Tổng hợp minh họa THPTQG 2019 Hóa Học có lời giải (Đề số 1)
Tổng hợp đề thi thử THPTQG 2019 - chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Bộ đề tăng tốc luyện thi Hóa Học cực hay có lời giải chi tiết (đề số 1)
15 Đề thi thử THPTQG 2019 Hóa Học chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Nội dung liên quan:
Danh sách câu hỏi:
Câu 1
Lời giải
Chọn đáp án C
Câu 2
Lời giải
Chọn đáp án D
Câu 3
Lời giải
Chọn đáp án B
Lời giải
Chọn đáp án C
Câu 5
Lời giải
Chọn đáp án A
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 9
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
A. \({\rm{F}}{{\rm{e}}^{2 + }}(aq).\)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 18
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 19
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 20
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 21
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 22
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 23
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 24
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 1
Trong mỗi ý a, b, c, d ở mỗi câu, hãy chọn đúng hoặc sai.
Mỗi phát biểu sau là đúng hay sai?
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 2
Nguyên tử sắt \(({\rm{Fe}})\) có cấu hình electron là \(1\;{{\rm{s}}^2}2\;{{\rm{s}}^2}2{{\rm{p}}^6}3\;{{\rm{s}}^2}3{{\rm{p}}^6}3\;{{\rm{d}}^6}4\;{{\rm{s}}^2}.\) Mỗi phát biểu sau là đúng hay sai?
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 3
Cho bảng số liệu sau của một số kim loại chuyển tiếp dãy thứ nhất như sau:
|
Kim loại |
Cr |
Mn |
Fe |
Co |
|
Cấu hình electron của nguyên tử |
\([{\rm{Ar}}]3\;{{\rm{d}}^5}4\;{{\rm{s}}^1}\) |
\([{\rm{Ar}}]3\;{{\rm{d}}^5}4\;{{\rm{s}}^2}\) |
\([{\rm{Ar}}]3\;{{\rm{d}}^6}4\;{{\rm{s}}^2}\) |
\([{\rm{Ar}}]3\;{{\rm{d}}^7}4\;{{\rm{s}}^2}\) |
|
\({\rm{E}}_{{{\rm{M}}^{2 + }}/{\rm{M}}}^{\rm{o}}({\rm{V}})\) |
\( - 0,912\) |
\( - 1,180\) |
\( - 0,440\) |
\( - 0,277\) |
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 4
Thực nghiệm cho biết số oxi hoá của các kim loại chuyển tiếp dãy thứ nhất theo bảng sau:
|
Nhóm |
IIIB |
IVB |
VB |
VIB |
VIIB |
VIIIB |
VIIIB |
VIIIB |
IB |
|
Nguyên tố |
\(_{21}{\rm{Sc}}\) |
\(_{22}{\rm{Ti}}\) |
\(_{23}\;{\rm{V}}\) |
\(_{24}{\rm{Cr}}\) |
\(_{25}{\rm{Mn}}\) |
\(_{26}{\rm{Fe}}\) |
\(_{27}{\rm{Co}}\) |
\(_{28}{\rm{Ni}}\) |
\(_{29}{\rm{Cu}}\) |
|
Các số oxi hoá |
|
|
|
|
\( + {7^{}}\) |
|
|
|
|
|
|
|
|
\( + 6\) |
+6 |
\( + {6^{}}\) |
|
|
|
|
|
|
|
\( + {5^{}}\) |
+5 |
+5 |
+5 |
+5 |
|
|
|
|
|
\( + {4^{}}\) |
\( + {4^{}}\) |
+4 |
\( + {4^{}}\) |
+4 |
+4 |
+4 |
|
|
|
\( + {3^{}}\) |
\( + {3^{}}\) |
\( + {3^{}}\) |
\( + {3^{}}\) |
+3 |
\( + {3^{}}\) |
\( + {3^{}}\) |
+3 |
+3 |
|
|
+2 |
+2 |
+2 |
\( + 2\) |
\( + {2^{}}\) |
\( + 2\) |
\( + {2^{}}\) |
\( + {2^{}}\) |
\( + {2^{}}\) |
|
|
+1 |
+1 |
+1 |
+1 |
+1 |
+1 |
+1 |
+1 |
\( + {1^*}\) |
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 5
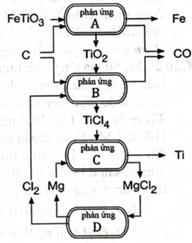
Titanium (Ti) được sử dụng để chế tạo động cơ hoặc khung máy bay, còn titanium dioxide \(\left( {{\rm{Ti}}{{\rm{O}}_2}} \right)\) được sử dụng trong sản xuất kem chống nắng. Quặng ilmenite \(\left( {{\rm{FeTi}}{{\rm{O}}_3}} \right)\) có giá trị quan trọng về mặt kinh tế để sản xuất kim loại titanium. \({\rm{Ti}}{{\rm{O}}_2}\) sản xuất từ \({\rm{FeTi}}{{\rm{O}}_3}\) (phản ứng A), sau đó được chuyển hoá thành Ti theo quy trình Kroll (phản ứng \({\rm{B}},{\rm{C}},{\rm{D}}\)).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 6
Chuẩn độ \({{\rm{V}}_1}\;{\rm{mL}}\) dung dịch chứa muối \({\rm{F}}{{\rm{e}}^{2 + }}\) nồng độ \({{\rm{C}}_1}({\rm{M}})\) và dung dịch \({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\) loãng, đựng trong bình tam giác bằng dung dịch \({\rm{KMn}}{{\rm{O}}_4}\) nồng độ \({{\rm{C}}_2}({\rm{M}})\) để ở burette và để ở vạch 0. Khi vạch thể tích dung dịch \({\rm{KMn}}{{\rm{O}}_4}\) trên burette là \({{\rm{V}}_2}\;{\rm{mL}}\) thì trong bình tam giác xuất hiện màu hồng bền trong khoảng 20 giây.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.