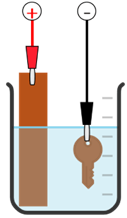
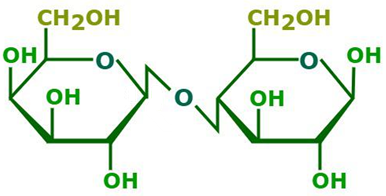
Đề thi thử tốt nghiệp THPT môn Hóa THPT Hương Khê - Hà Tĩnh (Lần 1) năm 2025 có đáp án
55 người thi tuần này 4.6 2 K lượt thi 40 câu hỏi 60 phút
🔥 Đề thi HOT:
Đề thi thử THPTQG 2019 môn Hóa học cực hay có lời giải chi tiết (P1)
Đề Ôn thi THPTQG 2019 Hóa Học cơ bản, nâng cao có lời giải chi tiết (P1)
Tổng hợp đề thi Thử Hóa học cực hay có lời giải (Đề số 1)
Đề thi thử Hóa học cực hay có lời giải chi tiết (đề số 1)
Tổng hợp minh họa THPTQG 2019 Hóa Học có lời giải (Đề số 1)
Tổng hợp đề thi thử THPTQG 2019 - chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Bộ đề tăng tốc luyện thi Hóa Học cực hay có lời giải chi tiết (đề số 1)
15 Đề thi thử THPTQG 2019 Hóa Học chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Nội dung liên quan:
Danh sách câu hỏi:
Câu 1
Lời giải
B
Tên gọi của ester HCOOC2H5 là ethyl formate.
Câu 2
Lời giải
D
Dẫn xuất halogen CH3Cl khi thủy phân bằng dung dịch NaOH cho CH3OH:
CH3Cl + NaOH → CH3OH + NaCl
Còn lại C6H5Cl không phản ứng, CH2Cl2 tạo HCHO, C2H5Cl tạo C2H5OH.
Câu 3
Lời giải
C
Kim loại Ba không phải là kim loại kiềm (nguyên tố nhóm IA). Ba là kim loại kiềm thổ (nhóm IIA).
Câu 4
Lời giải
A
Công thức của cellulose là (C6H10O5)n.
Câu 5
Lời giải
D
Trong điều kiện thích hợp glucose lên men tạo thành khí CO2 và C2H5OH:
C6H12O6 → 2C2H5OH + 2CO2
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 9
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 18
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 1
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
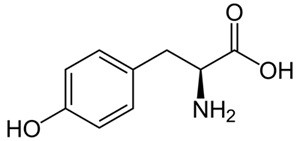
Tyrosine là một trong những loại amino acid cần thiết và có thể bổ sung cho cơ thể thông qua các thực phẩm ăn uống hàng ngày. Tyrosine làm tăng mức độ chất dẫn truyền tế bào thần kinh dopamine, adrenaline và norepinephrine giúp điều chỉnh tâm trạng, cải thiện trí nhớ, giúp tỉnh táo đầu ốc và tăng khả năng tập trung. Cơ thể có thể tổng hợp tyrosine từ các loại thực phẩm như thịt, cá, trứng, sản phẩm từ sữa, đậu, các loại hạt, yển mạch và lúa mì. Tyrosine có cấu tạo như hình bên.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 2
Người ta điều chế H2 và O2 bằng cách điện phân m gam dung dịch NaOH C% với điện cực trơ, cường độ dòng điện 0,67A trong thời gian 40 giờ. Dung dịch thu được sau điện phân có khối lượng 100 gam và nồng độ NaOH là 6%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 3
Isoamyl acetate thường được sử dụng làm chất phụ gia để tạo mùi chuối trong thực phẩm hoặc được dùng làm hương liệu nhân tạo. Một học sinh tiến hành điều chế isoamyl acetate theo các bước sau :
Bước 1: Cho vào bình cầu 26,4 mL isoamyl alcohol (d = 0,81 g/mL), 40 mL acetic acid (d =1,049 g/mL) và 2,5 mL H2SO4 đậm đặc, cho thêm vào bình vài viên đá bọt. Lắp ống sinh hàn hồi lưu thẳng đứng vào miệng bình cầu. Sau đó đun nóng bình cầu trong khoảng 1,5 giờ.
Bước 2: Sau khi đun, để nguội rồi rót sản phẩm vào phễu chiết, thêm 50 mL nước cất vào phiễu, lắc đều rồi để yên khoảng 5 phút, lúc đó chất lỏng tách thành hai lớp, loại bỏ phần chất lỏng phía dưới, lấy phần chất lỏng phía trên.
Bước 3: Cho từ từ dung dịch Na2CO3 10% vào phần chất lỏng thu lấy ở bước 2 và lắc đều cho đến khi không còn khí thoát ra, thêm tiếp 20 mL dung dịch NaCl bão hòa rồi để yên khi đó chất lỏng tách thành hai lớp. Chiết lấy phần chất lỏng phía trên, thu được 26,0 mL isoamyl acetate (d = 0,876 g/mL).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 4
Dung dịch acetic acid 2% - 5% trong nước gọi là giấm ăn. Một trong những phương pháp cổ nhất ngày nay vẫn dùng để sản xuất giấm ăn là lên men ethanol. Một người đã thực hiện lên men 500 mL dung dịch ethanol 4,6° với hiệu suất của quá trình lên men là 85% và khối lượng riêng của ethanol là 0,8 g/mL.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.