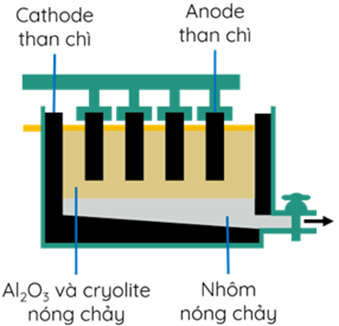
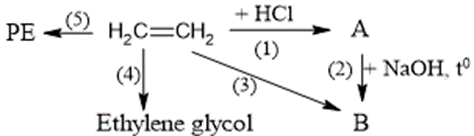Đề thi thử tốt nghiệp THPT môn Hóa học Sở GDĐT Ninh Bình (lần 2) có đáp án
62 người thi tuần này 4.6 2.6 K lượt thi 40 câu hỏi 60 phút
🔥 Đề thi HOT:
Đề thi thử THPTQG 2019 môn Hóa học cực hay có lời giải chi tiết (P1)
Đề Ôn thi THPTQG 2019 Hóa Học cơ bản, nâng cao có lời giải chi tiết (P1)
Tổng hợp đề thi Thử Hóa học cực hay có lời giải (Đề số 1)
Đề thi thử Hóa học cực hay có lời giải chi tiết (đề số 1)
Tổng hợp minh họa THPTQG 2019 Hóa Học có lời giải (Đề số 1)
Tổng hợp đề thi thử THPTQG 2019 - chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Bộ đề tăng tốc luyện thi Hóa Học cực hay có lời giải chi tiết (đề số 1)
15 Đề thi thử THPTQG 2019 Hóa Học chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Nội dung liên quan:
Danh sách câu hỏi:
Lời giải
Đáp án đúng là: B
X có 7 mắt xích, tạo bởi 7 amino axit (Gly, Ala, Val, Glu, Ser, His, Leu) nên mỗi mắt xích chỉ xuất hiện 1 lần duy nhất.
Sản phẩm Ser-His-Leu và His-Leu-Val → X có đoạn Ser-His-Leu-Val
Sản phẩm có Val-Glu-Ala → X có đoạn Ser-His-Leu-Val-Glu-Ala
Sản phẩm có Gly-Ser-His → X là
Gly-Ser-His-Leu-Val-Glu-Ala
→ Val ở vị trí số 5.
Câu 2
Lời giải
Đáp án đúng là: C
Trong quá trình Fe3+ + 1e → Fe2+ dạng oxi hóa là Fe3+, dạng khử là Fe2+
→ Cặp oxi hóa – khử trong quá trình này là Fe3+/Fe2+.
Câu 3
Lời giải
Đáp án đúng là: C
Ở giai đoạn đầu của phản ứng điện phân, tại cathode Ag+ bị khử:
Ag+(aq) + e → Ag(s).
Lời giải
Đáp án đúng là: A
Có 4 đồng phân alkene có công thức phân tử C4H8:
CH2=CH-CH2-CH3
CH3-CH=CH-CH3 (Cis – Trans)
CH2=C(CH3)2
Câu 5
Lời giải
Đáp án đúng là: A
Trong các ion trên, ion Ag+ có tính oxi hoá mạnh nhất ở điều kiện chuẩn (Tính oxi hóa Ag+ > Cu2+ > Fe2+ > Al3+).
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 18
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 1
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Trên thế giới, zinc (kẽm) được sản xuất chủ yếu từ quặng zinc blende có thành phần chính là ZnS. Một nhà máy luyện kim sản xuất Zn từ 60 tấn quặng zinc blend (chứa 80% ZnS về khối lượng, còn lại là tạp chất không chứa kẽm) với hiệu suất cả quá trình đạt 90% theo các giai đoạn:
+ Đốt quặng zinc blende: 2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2(g) (1)
+ Khử zinc oxide ở nhiệt độ cao bằng than cốc: ZnO(s) + C(s) → Zn(g) + CO(g) (2)
Toàn bộ lượng kẽm tạo ra được đúc thành k thanh kẽm hình hộp chữ nhật: chiều dài 120 cm, chiều rộng 25 cm và chiều cao 15 cm. Biết khối lượng riêng của kẽm là 7,14 g/cm³.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 2
Phân tích nguyên tố hợp chất hữu cơ E cho kết quả phần trăm khối lượng carbon, hydrogen và oxygen lần lượt là 48,65%; 8,11% và 43,24%. Dựa vào phương pháp phân tích khối phổ (MS) xác định được phân tử khối của E là 74. Mặt khác, phổ hồng ngoại (IR) cho thấy phân tử E không chứa nhóm -OH (peak có số sóng > 3000 cm-1) nhưng lại chứa nhóm C=O (peak có số sóng 1748 cm-1). Thuỷ phân hoàn toàn E trong dung dịch NaOH, thu được muối của carboxylic acid X và chất Y. Chất Y có nhiệt độ sôi (64,7°C) nhỏ hơn nhiệt độ sôi của ethanol (78,3°C) (nhiệt độ sôi đều đo ở áp suất 1 bar).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 3
Cho X, Y, Z, M là các chất khác nhau trong số 4 chất sau: phenol, glycine, aniline, glutamic acid và thông tin về các chất được ghi trong bảng sau:
|
Chất |
Nhiệt độ nóng chảy (°C) |
Cho quỳ tím vào dung dịch các chất |
|
X |
-6,0 |
không làm đổi màu quỳ tím. |
|
Y |
233 |
không làm đổi màu quỳ tím. |
|
Z |
247 |
làm quỳ tím chuyển thành màu hồng. |
|
M |
43 |
không làm đổi màu quỳ tím. |
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 4
Công đoạn chính của công nghiệp chlorine – kiềm là điện phân dung dịch sodium chloride bão hòa trong bể điện phân có màng ngăn xốp. Phương trình hóa học của phản ứng điện phân dung dịch NaCl bão hòa trong bể điện phân có màng ngăn như sau:
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + H2(g) + Cl2(g)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.