Đề thi thử tốt nghiệp THPT môn Hóa THPT Lương Ngọc Quyến - Thái Nguyên (Lần 1) năm 2025 có đáp án
49 người thi tuần này 4.6 1.8 K lượt thi 40 câu hỏi 45 phút
🔥 Đề thi HOT:
Đề thi thử THPTQG 2019 môn Hóa học cực hay có lời giải chi tiết (P1)
Đề Ôn thi THPTQG 2019 Hóa Học cơ bản, nâng cao có lời giải chi tiết (P1)
Tổng hợp đề thi Thử Hóa học cực hay có lời giải (Đề số 1)
Đề thi thử Hóa học cực hay có lời giải chi tiết (đề số 1)
Tổng hợp minh họa THPTQG 2019 Hóa Học có lời giải (Đề số 1)
Tổng hợp đề thi thử THPTQG 2019 - chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Bộ đề tăng tốc luyện thi Hóa Học cực hay có lời giải chi tiết (đề số 1)
15 Đề thi thử THPTQG 2019 Hóa Học chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Nội dung liên quan:
Danh sách câu hỏi:
Câu 1
Lời giải
C
(C17H33COO)3C3H5 + 3NaOH → 3C17H33COONa + C3H5(OH)3
Muối X là C17H33COONa
Câu 2
Lời giải
C
Tính khử: Cr > Zn > Cr2+ > Ni
Tính oxi hóa: Ni2+ > Cr3+ > Zn2+ > Cr2+
→ Phản ứng đúng là Zn + 2Cr3+ → Zn2+ + 2Cr2+.
Câu 3
Lời giải
D
Lớp ngoài cùng của X là lớp thứ 3, có 4 electron → Cấu hình lớp ngoài cùng: 3s23p2
→ Cấu hình đầy đủ: 1s22s22p63s23p2.
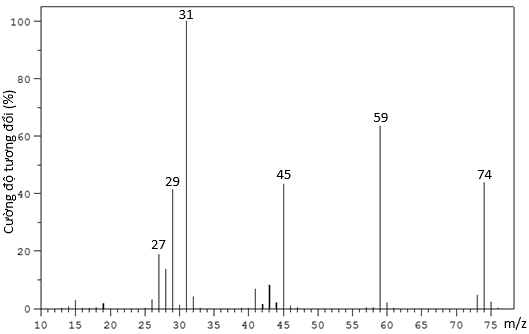
Câu 4
Lời giải
C
MX = 74 nên X có thể là C4H10O.
Đồng phân ether của X có khả năng gây mê, giảm đau và giãn cơ.
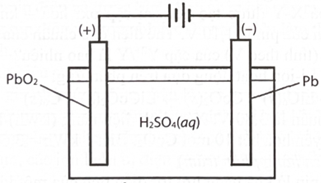
Lời giải
C
Khi phóng điện:
Anode (-): Pb + SO42- → PbSO4 + 2e
Cathode (+): PbO2 + H2SO4 + 2H+ + 2e → PbSO4 + 2H2O
(a) Sai, tại anode chì bị oxi hóa tạo thành PbSO4.
(b) Sai, tại cathode PbO2 bị khử tạo thành PbSO4.
(c) Sai, khi phóng điện khối lượng các điện cực đều tăng do các chuyển hóa Pb (207) → PbSO4 (303) và PbO2 (239) → PbSO4 (303).
(d) Đúng, H2SO4 tham gia phản ứng ở các điện cực tạo kết tủa nên nồng độ giảm.
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 9
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 16
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 17
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 18
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 1
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Linalyl acetate là một trong những chất của tinh dầu cam và mùi thơm của hoa oải hương. Cho công thức cấu tạo của linlalyl acetate như sau :
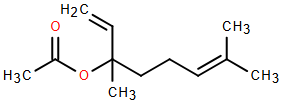
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 2
Sắt có số hiệu nguyên tử là 26. Trong vỏ Trái Đất, sắt là nguyên tố kim loại phổ biến thứ 2 (sau nhôm). Ứng dụng chủ yếu của sắt là để tạo ra các hợp kim thép dùng trong xây dựng và chế tạo.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 3
Máy tạo nhịp tim là một thiết bị nhỏ dùng để điều trị một số chứng rối loạn nhịp tim. Khi bị rối loạn nhịp tim, tim có thể đập quá nhanh, quá chậm hoặc nhịp tim không đều. Máy tạo nhịp tim gửi các xung điện để giúp tim đập ở tốc độ và nhịp điệu bình thường. Máy tạo nhịp tim gồm có 2 phần chính: máy tạo nhịp (Pacemaker) và dây điện cực (Electrode). Bộ phận quan trọng nhất của máy tạo nhịp tim là một hệ pin điện hóa lithium – iodine (gồm hai cặp oxi hóa khử Li+/Li và I2/2I-). Hai điện cực được đặt vào tim, phát sinh dòng điện nhỏ kích thích tim đập ổn định. Cho biết: E°Li+/Li = -3,04V; E°I2/2I- = +0,54V; Nguyên tử khối của Li = 6,9; điện tích của 1 mol electron là 96500 C/mol; q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s), 1 năm = 365 ngày.
q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s), 1 năm = 365 ngày.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 4
Để tạo ra mật ong, mỗi con ong thợ phải sử dụng những chiếc vòi của mình hút mật từ hoa và lưu trữ nó trong túi dạ dày đặc biệt. Mỗi túi mật có thể lưu trữ đến gần 70mg mật hoa. Để đầy túi dạ dày, mỗi con ong cần từ 100 đến 1500 bông hoa, tùy thuộc vào loại hoa và năng lượng cần thiết. Sau khi túi dạ dày đầy, chúng trở về tổ và chuyển mật hoa cho những con ong thợ khác, ong thợ nhận mật hoa và lưu giữ trong miệng của mình. Sau đó, trong khoảng nửa tiếng, chúng “nhai” mật hoa, cho phép enzim trong miệng phân hủy các loại đường phức tạp trong mật hoa thành các loại đường đơn giản.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.