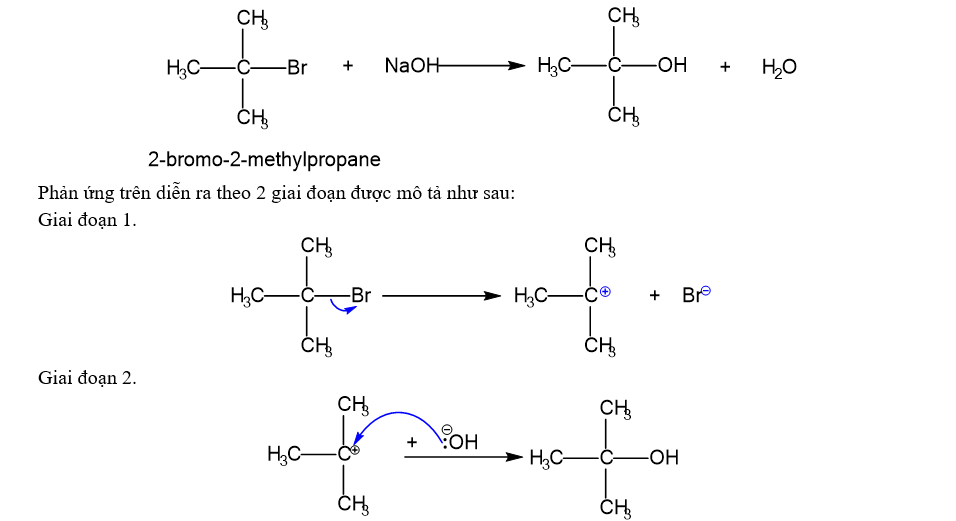
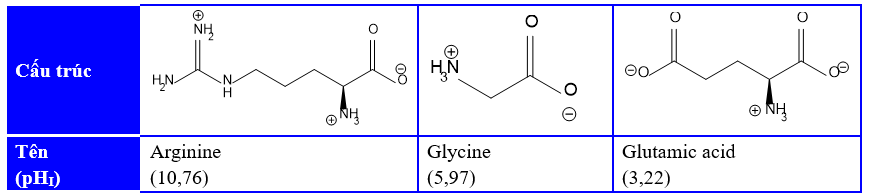
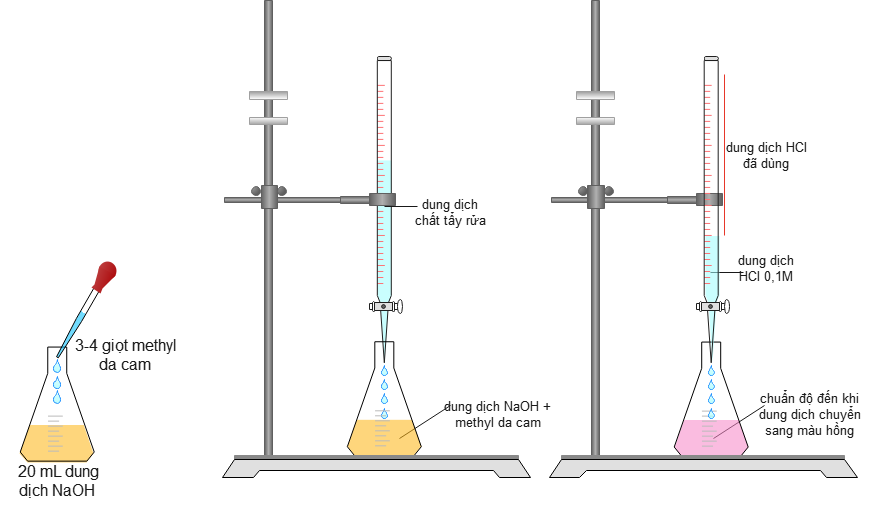
Đề thi thử Tốt nghiệp THPT 2025 - Cấu trúc mới - Môn Hóa Học - Đề 2
85 người thi tuần này 4.6 2.8 K lượt thi 40 câu hỏi 60 phút
🔥 Đề thi HOT:
Đề thi thử THPTQG 2019 môn Hóa học cực hay có lời giải chi tiết (P1)
Đề Ôn thi THPTQG 2019 Hóa Học cơ bản, nâng cao có lời giải chi tiết (P1)
Tổng hợp đề thi Thử Hóa học cực hay có lời giải (Đề số 1)
Đề thi thử Hóa học cực hay có lời giải chi tiết (đề số 1)
Tổng hợp minh họa THPTQG 2019 Hóa Học có lời giải (Đề số 1)
Tổng hợp đề thi thử THPTQG 2019 - chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Bộ đề tăng tốc luyện thi Hóa Học cực hay có lời giải chi tiết (đề số 1)
15 Đề thi thử THPTQG 2019 Hóa Học chuẩn cấu trúc của bộ giáo dục (Đề số 1)
Nội dung liên quan:
Danh sách câu hỏi:
Câu 1
Lời giải
Chọn B
Câu 2
Lời giải
Chọn D
Câu 3
Lời giải
Chọn B
Câu 4
Lời giải
Chọn C
Câu 5
Lời giải
Chọn B
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
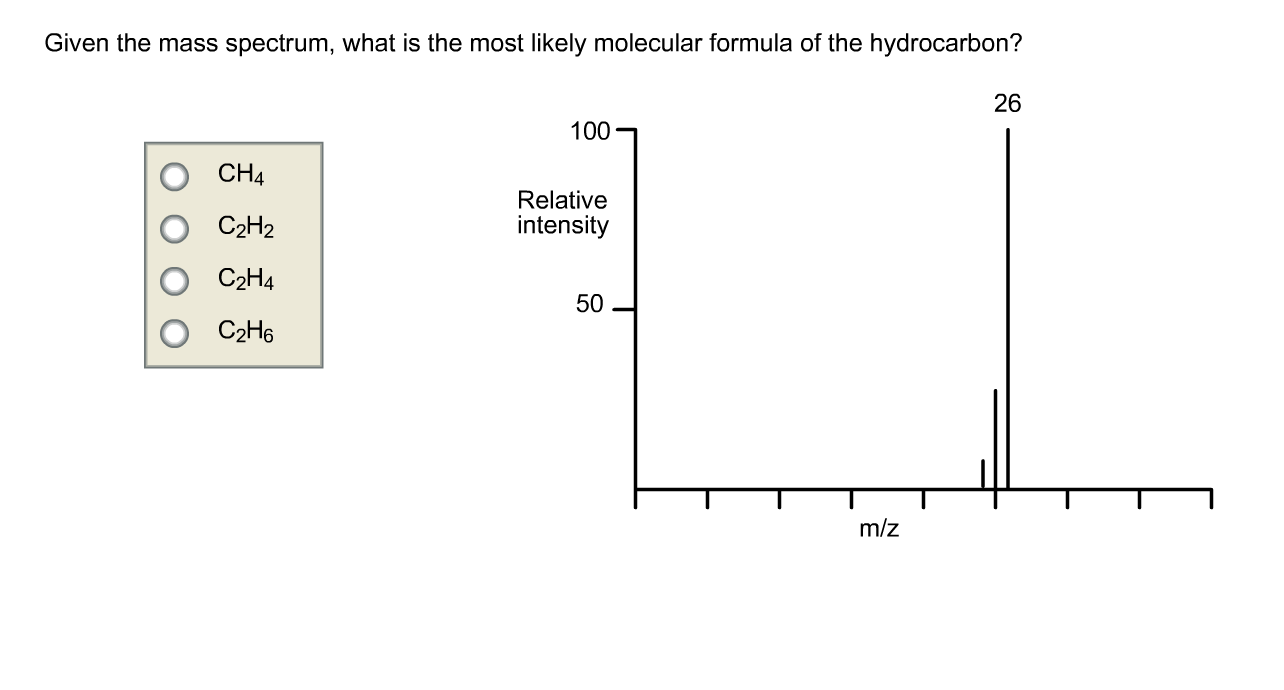
Câu 8
C. C2H4.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 9
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 14
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 1
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 - 18:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
|
Cặp oxi hóa - khử |
Al3+/Al |
Zn2+/Zn |
Fe2+/Fe |
Cu2+/Cu |
Ag+/Ag |
|
E0(V) |
-1,676 |
-0,763 |
-0,440 |
0,340 |
0,799 |
Câu 23
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 24
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 2
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4 . Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Trong công nghiệp, xút (sodium hydroxide) được sản xuất bằng phương pháp điện phân dung dịch sodium chloride có màng ngăn xốp. Bằng phương pháp này, người ta cũng thu được khí chlorine. Chất khí này được làm khô (loại hơi nước) rồi hoá lỏng để làm nguyên liệu quan trọng cho nhiều ngành công nghiệp chế biến và sản xuất hoá chất.
Từ quá trình điện phân nêu trên, một lượng chlorine và hydrogen sinh ra được tận dụng để sản xuất hydrochloric acid đặc thương phẩm (32%, D = 1,153 g/mL ở 30 °C).
Một nhà máy với quy mô sản xuất 200 tấn xút mỗi ngày thì đồng thời sản xuất được bao nhiêu m3 acid thương phẩm trên. Biết rằng, tại nhà máy này, 60% khối lượng chlorine sinh ra được dùng tổng hợp hydrochloric acid và hiệu suất của toàn bộ quá trình từ chlorine đến acid thương phẩm đạt 80% về khối lượng.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 3
Nấm men là chất xúc tác cho phản ứng lên men ethyl alcohol trong điều kiện không có khí oxygen. Quá trình lên men là một quá trình tỏa nhiệt.Từ 250 gam glucose, thực hiện quá trình lên men rượu trong phòng thí nghiệm, kết quả biểu diễn theo đồ thị sau:
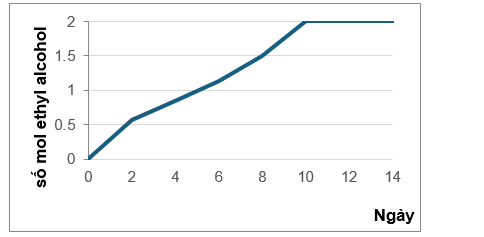
Kết quả nghiên cứu nhận thấy:
• Tốc độ phản ứng tăng lên và dung dịch trở nên đặc và ấm hơn.
• Sau một thời gian từ ngày thứ 10 phản ứng hầu như dừng lại dù trong dung dịch vẫn còn glucose.
a. Phương trình lên men glucose là : C6H12O6 2C2H5OH + CO2
b. Trong quá trình lên men ngoại trừ ethyl alcohol thì còn có thể tạo thành một số sản phẩm như CH3CHO, CH3COOH, CH3COOC2H5.
c. Dung dịch trở nên đặc hơn là do khí CO2 bay ra làm khối lượng dung dịch tăng nên nồng độ dung dịch tăng lên.
d. Hiệu suất lên men của ngày thứ 10 là 78%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 4
Ba hợp chất thơm A, B, C đều có ứng dụng trong thực tiễn: A có tác dụng chống sinh vật kí sinh (chấy, rận); B làm chất tạo mùi hạnh nhân; C là một thành phần của thuốc mỡ Whitfield, được dùng để điều trị các bệnh về da như nấm da, giun đũa và chân của vận động viên. Cho biết A là một alcohol bậc I có CTCT là C6H5CH2OH. Sơ đồ chuyển hoá giữa ba chất A, B, C như sau:
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Đoạn văn 5
Muối FeCl3 khan là những tinh thể có màu vàng nâu. Hoà tan một lượng muối này vào nước, thu được dung dịch có màu vàng nhạt (có chứa phức chất X). Lấy một ít dung dịch muối trên cho vào dung dịch KSCN thì thấy xuất hiện màu đỏ đặc trưng, để giải thích hiện tượng trên là do xảy ra sự tạo phức như sau:
Fe3+ + SCN- [Fe(SCN)]2+
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.